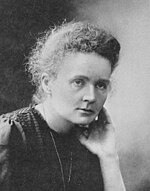锔
原子序数为96的化学元素
鋦是一種銀白色的堅硬高密度金屬,熔點和沸點是錒系元素中較高的。鋦在標準溫度和壓力下具順磁性,並在冷卻後變為反鐵磁性;許多鋦化合物也具有磁性的轉變。鋦在化合物中的氧化態通常為+3和+4,而在溶液中主要呈+3態。鋦很容易被氧化,而形成的氧化物是鋦最常見的形態。鋦可以和各種有機化合物形成螢光配合物,但不出現在任何細菌或古菌中。當攝入人體之後,鋦會累積在骨骼、肺部和肝臟中,並可致癌。
鋦的所有已知同位素都具有放射性,並具有較小的臨界質量(維持核連鎖反應所需的最低質量)。這些同位素主要放射α粒子,輻射釋放的熱量可以在放射性同位素熱電機中用來產生電力。然而由於量的稀少,以及製造費用的昂貴,鋦難以用來發電。鋦被用於製造更重的錒系元素,及在心律調節器中作為能源的238Pu。它也作為α粒子射源,被用在α粒子X射線光譜儀中。許多火星探測任務都使用該光譜儀來分析火星表面岩石的結構和成份,羅塞塔號的菲萊登陸器(Philae Lander)也用它來探測楚留莫夫-格拉希門克彗星的表面。
歷史编辑


雖然過去的核反應實驗中很可能已經產生了鋦元素,但是要直到1944年,伯克利加州大學的格倫·西奧多·西博格、拉尔夫·A·詹姆斯(Ralph A. James)和阿伯特·吉奧索等人才首次專門合成並分離出鋦。他們的實驗使用了1.5米直徑迴旋加速器。[7]
鋦的化學辨認是在芝加哥大學的冶金實驗室(現阿貢國家實驗室)進行的。它是第三個被發現的超鈾元素,但在元素週期表中卻是第四個超鈾元素(當時仍未發現鋂)。[8][9]
鋦的合成過程如下:首先將硝酸鈈溶液塗在面積約為0.5 cm2的鉑薄片上,蒸發後的殘留物經退火轉換為二氧化鈈(PuO2)。二氧化鈈在迴旋加速器中受照射之後,產物溶於硝酸中,再用濃氨水沉澱為氫氧化物。沉澱物溶於高氯酸,再用離子交換分離出鋦的某個同位素。由於鋦的分離過程十分繁複,以致發現團隊最初稱其為Pandemonium(希臘文中意為「群魔殿」或「地獄」)。[10][11][12]
1944年7至8月,239Pu經α粒子撞擊後,產生了鋦-242同位素,並釋放了一顆中子:
科學家根據衰變時釋放的α粒子的特徵能量,確切地辨認了鋦-242:
這條α衰變的半衰期最初測得為150天,後改為162.8天。[13]
1945年3月進行的另一條反應又產生了240Cm同位素:
該同位素的α衰變半衰期為26.7。[13]
鋦和鋂在1944年的發現與當時旨在製造原子彈的曼哈頓計劃息息相關。有關其發現的信息一直保密到1945年才公諸於世。在1945年11月11日美國化學學會正式發佈鋦和鋂的發現前5天,美國電台節目「Quiz Kids」(小朋友問答)的一位聽眾問到,戰時除了鎿和鈈之外還有沒有發現其他新的超鈾元素,格倫·西博格回應時洩露了有關發現鋦和鋂的消息。[10]
鋦是以瑪莉·居禮(Marie Curie)和其丈夫皮埃爾·居禮(Pierre Curie)命名的。兩人發現了鐳元素,並對放射性作出了相當的貢獻。這種命名方法參照了元素週期表中位於鋦以上的鑭系元素釓:釓是以研究稀土元素的科學家、工程師約翰·加多林命名的。[14]
最初製成的鋦樣本數量很少,肉眼僅僅可見。科學家利用其放射特性,辨認出鋦元素。Louis Werner和Isadore Perlman在1947年於加州大學對鋂-241進行中子撞擊,首次製備了重30 µg的可觀量氫氧化鋦-242。[15][16][17] W. W. T. Crane、J. C. Wallmann和B. B. Cunningham在1950年製成了宏觀量的氟化鋦,其磁性和GdF3相似。這首次提供了實驗證據,證明鋦在其化合物中具+3氧化態。[15]1951年,科學家用鋇還原氟化鋦,唯一一次製成了金屬態的鋦。[18][19]
特性编辑
物理特性编辑


鋦是一種放射性人工合成元素,也是質地堅硬、密度高的銀白色金屬。其物理和化學特性與其上方的鑭系元素釓相似。鋦的熔點為1340 °C,這比前面的超鈾元素鎿(637 °C)、鈈(639 °C)和鋂(1173 °C)都要高,而釓的熔點則在1312 °C。鋦的沸點為3110 °C,密度為13.52 g/cm3。這比鎿(20.45 g/cm3)和鈈(19.8 g/cm3)的密度低,但仍比大部分金屬高。鋦的兩種晶體結構中,α型在標準溫度和壓力下更穩定。其具有六方對稱結構,空間群為P63/mmc,晶格參數a = 365 pm,c = 1182 pm,且每晶胞含四個化學式單位。[20]該晶體具有雙六方密排結構,層序為ABAC,並和α鑭同型。在23 GPa壓力以上及室溫下,α鋦會轉變為β鋦。β型具有面心立方對稱結構,空間群為Fm3m,晶格常數a = 493 pm。[20]進一步加壓到43 GPa後,鋦會變為屬於正交晶系的γ鋦結構,與α鈾同型,並一直到52 GPa都不會再有相變。這三種鋦的相態也被稱為Cm I、II和III。[21][22]
鋦的磁特性奇特。其旁邊的镅元素在不同溫度下都不會偏離居里外斯順磁性,但α鋦會在冷卻至65至52 K時轉變為反鐵磁性,[23][24]而β鋦在大約205 K時轉變成亞鐵磁性。另外,鋦和氮族元素的化合物在冷卻後會轉成鐵磁性:244CmN和244CmAs於109 K,248CmP於73 K,248CmSb於162 K。鋦的鑭系同類物釓以及釓的氮族元素化合物也會在冷卻時轉變磁性,但稍有不同:Gd和GdN變為鐵磁性,而GdP、GdAs和GdSb則具反鐵磁性。[25]
鋦的電阻率會隨溫度而變化:在4至60 K時大約翻倍,並從60 K到室溫幾乎保持恒等。由於其釋放的α輻射會破壞自身的晶體結構,因此其電阻率會隨時間快速提高,約10 µOhm·cm/h。故此很難確定鋦的絕對電阻率(約125 µΩ·cm)。鋦的電阻率與釓、鈈和鎿相近,但比鋂、鈾、釙和釷高出許多。[6][26]
在紫外線照射下,鋦(III)離子會發出強烈且穩定的橘黃色螢光,極值位於590至640 nm區間內,隨環境條件而變化。[27]這種螢光特性是來自第一激發態6D7/2與基態8S7/2之間的轉變。通過分析發出的螢光,可以監測有機及無機配合物中Cm(III)離子間的交互作用。[28]
化學特性编辑
鋦的最穩定氧化態為+3,其離子在溶液中也具有+3態。[29]:24其+4態只出現在少有的幾個固態化合物中,如CmO2和CmF4。[30][31]鋦的化學特性與同為錒系元素的釷和鈾不同,但和鋂及許多鑭系元素相似。在水溶液中,Cm3+離子可以是無色或淺綠色的,[32]而Cm4+離子則是淺黃色的。[33]Cm3+的吸收光譜在375.4、381.2和396.5納米波長處有尖銳的峰值,這些峰值的強度可以直接用來測量該離子的濃度。[29]:25-26鋦離子屬於硬酸,因此可以和硬鹼產生最穩定的配合物。[34]兩者間形成的主要為離子鍵,但含少量共價鍵的部分。[35]配合物中的鋦主要以三帽三角菱柱形配位。[36]
化合物及反應编辑
氧化物编辑
鋦會和氧迅速反應,主要形成Cm2O3和CmO2,[37]另也會形成二價氧化鋦:CmO。[33]:1972草酸鋦(Cm2(C2O4)3)、硝酸鋦(Cm(NO3)3)或氫氧化鋦在純氧中燃燒後可製成呈黑色的CmO2。[31][38]當在真空中(約0.01 Pa壓力下)加熱到約600至650 °C度時,該氧化物會轉變成呈白色的Cm2O3:[31][39]
另一種制得Cm2O3的方法是使用氫氣對CmO2進行還原反應:[40]
其他已知的氧化物還包括諸如M(II)CmO3型的三元氧化物,其中的M表示任何一種二價金屬,如鋇。[41]
鹵化物编辑
對含有三價鋦離子的溶液注入氟離子,可產生無色的三氟化鋦(CmF3)。呈棕色的四氟化鋦(CmF4)則只能通過三氟化鋦和氟氣間的反應才能形成:[9]
鋦還可以形成A7Cm6F31型的三元氟化物,其中的A表示鹼金屬。[42]
氫氧化鋦(III)(Cm(OH)3)與無水氯化氫氣體反應後,會形成無色的三氯化鋦(CmCl3)。要製造其他的鋦鹵化物,可在約400至450 °C的高溫下,使三氯化鋦與對應的鹵化銨鹽反應。以此方法可制得三溴化鋦(無色至淺綠色)及三碘化鋦(無色):[43]
另一種方法須把氧化鋦和對應的酸一起加熱到600 °C(比如,要製造溴化鋦,則要使用氫溴酸)。[44][45]對三氯化鋦進行氣態水解後,會產生氯氧化鋦:[46]
氧族及氮族元素化合物编辑
在高溫下真空中使鋦與氣態硫、硒或碲反應,可分別製成鋦的硫化物、硒化物和碲化物。[47][48]氮族的氮、磷、砷和銻可以和鋦形成化學式為CmX的化合物。[9]要製造這些化合物,可在高溫下使三氫化鋦(CmH3)或金屬鋦與對應的氮族元素進行反應。
有機化合物编辑

釷、鏷、鎿、鈈和鋂等錒系元素都具有類似於双(环辛四烯)合铀的金屬有機配合物。分子軌道理論預測存在双(环辛四烯)合鋦 (η8-C8H8)2Cm,但至今仍待實驗證明。[49][50]
延伸X光吸收細微結構(EXAFS)已證實,在含有n-C3H7-BTP和Cm3+離子的溶液中,存在Cm(n-C3H7-BTP)3型的配合物,其中BTP指2,6-二(1,2,4-三嗪-3-基)吡啶。某些BTP型配合物只和鋦相互作用,因此在提取鋦的過程中相當有用。[27][51]溶解了的Cm3+離子會和許多有機化合物反應,包括異羥肟酸、[52]尿素、[53]螢光素、[54]和三磷酸腺苷等。[55]這些化合物都和各種微生物的內部活動相關。如此產生的配合物在紫外線的照射激發下,會發出強烈的橘黃色螢光。這不但使鋦的探測過程更為方便,更可以通過觀測半衰期的改變(約0.1毫秒數量級)及螢光光譜的變化,來研究Cm3+離子與配體間的交互作用。[28][52][53][54][55]
鋦在生物體中沒有已知的用途。[56]一些報告曾表明,細菌和古菌會吸附Cm3+離子,但鋦並沒有摻入這些生物體內。[57][58]
同位素编辑
| 熱中子截面(靶恩)[59] | ||||||
|---|---|---|---|---|---|---|
| 242Cm | 243Cm | 244Cm | 245Cm | 246Cm | 247Cm | |
| 裂變 | 5 | 617 | 1.04 | 2145 | 0.14 | 81.90 |
| 捕獲 | 16 | 130 | 15.20 | 369 | 1.22 | 57 |
| 捕獲/裂變比 | 3.20 | 0.21 | 14.62 | 0.17 | 8.71 | 0.70 |
| 53 MWd/kg的燃燒20年後的低濃縮鈾乏核燃料[60] | ||||||
| 3種常見同位素 | 51 | 3700 | 390 | |||
| 快中子反應爐中的混合氧化物核燃料(5個樣本的平均值,燃燒度為66-120GWd/t)[61] | ||||||
| 總含鋦量3.09×10-3% | 27.64% | 70.16% | 2.166% | 0.0376% | 0.000928% | |
| 同位素 | 242Cm | 243Cm | 244Cm | 245Cm | 246Cm | 247Cm | 248Cm | 250Cm |
| 臨界質量(kg) | 25 | 7.5 | 33 | 6.8 | 39 | 7 | 40.4 | 23.5 |
鋦約有20種已知的同位素及7種同核異構體,質量數從233到252不等。這些同位素都具有放射性,其中半衰期最長的有247Cm(1560萬年)和248Cm(348,000年);其他長半衰期的同位素包括245Cm(8500年)、250Cm(8,300年)和246Cm(4,760年)。鋦-250較為特殊,主要以自發裂變的形式衰變(86%機率)。最常用的鋦同位素為242Cm和244Cm,半衰期分別為162.8天和18.1年。[13]

所有242Cm和248Cm之間的同位素,以及250Cm,都可以維持核連鎖反應,因此理論上能在反應爐中作核燃料之用。正如多數超鈾元素一樣,質量數為奇數的鋦同位素243Cm、245Cm和247Cm的核裂變截面特別高,都可以被用在熱中子反應爐中。然而,所有鋦同位素的混合物則只能用於快中子增殖反應堆中,因為質量數為偶數的鋦同位素在熱中子反應爐中不會裂變,並會隨燃燒度的提高而累積。[63]當在發電反應爐中使用混合氧化物(MOX)燃料時,該燃料不應含有鋦元素。這是因為中子活化會使248Cm變為鉲,而鉲是一種強中子射源,除了會污染核燃料循環的後部,還會對反應爐操作人員造成過量輻射的危險。因此,若要使用次錒系元素(鈾和鈈以外的錒系元素)作為熱中子反應爐中的核燃料,則應從燃料中完全移除鋦元素,或將鋦置於特殊的燃料柱中作為燃料中的唯一一種錒系元素。[64]
右表列出鋦同位素做成球體,且不使用減速劑或反射器時的臨界質量。如加上金屬反射器(厚30 cm的鋼鐵),則奇數同位素的臨界質量大約為3至4 kg。如使用水(厚度約20至30 cm)作為反射器,則臨界質量可以大大下降:245Cm可降至59克,243Cm為155克,而247Cm為1550克。這些數值具有很高的不確定度。[63][65]
由於產量稀少,造价昂貴,目前鋦並沒有被用作核燃料。[66]245Cm和247Cm的臨界質量很小,理論上可用於製造便攜核武器,但至今沒有相關的報導。鋦-243的半衰期很短,會產生過量熱量,因此不可用於核武器中。[67]鋦-247的半衰期是鈈-239的647倍,因此很適合用來製造核武器。
存量编辑

鋦-247是鋦同位素中半衰期最長的,有1560萬年,但仍遠短於地球的年齡。因此,所有原始的鋦元素,也就是在地球形成時可能存在的鋦,至今都已全部衰變殆盡。現今地球上的鋦大多出現在乏核燃料中,其餘則是通過人工製造的,主要用於科學研究。1945至1980年大氣層核試驗的進行地點存有一定的鋦元素。[37]美國第一顆氫彈「常春藤麥克」(1952年11月1日於埃內韋塔克環礁引爆)的輻射落塵中,除了含有鑀、鐨、鈈和鋂之外,還有錇、鉲和鋦的一些同位素,其中包括245Cm、246Cm及更少量的247Cm、248Cm和249Cm。由於正值冷戰時期,這些結果起初被列為軍事機密,到1956年才正式公佈。[68]
大氣層中的鋦化合物較難溶於常見的溶劑中,但會黏附在泥土粒子上。分析表明,沙粒表面上的含鋦量比其周圍的水高出大約4,000倍;壤土中該比例甚至可高達18,000倍。[69]
含鈾量極高的礦藏中,重元素經中子捕獲和β衰變之後,可能會自然產生痕量的鋦,儘管這一點尚未得到證實。[70][71]從95號鋂至100號鐨的超鈾元素,包括鋦,都曾在位於加彭奧克洛的天然核反應爐中自然產生,但至今已不再形成了。[72]
合成编辑
同位素的製備编辑
鋦是在核反應爐中少量產生的。到目前為止,242Cm和244Cm的總產量只有幾公斤,其餘更重的同位素只有數克或甚至數毫克的總產量。故此鋦的價格昂貴,每毫克160至185美元;[15]更近期的估價為:242Cm每克2,000美元,244Cm每克170美元。[73]在反應爐中,238U可以通過一系列的核反應形成鋦。首先238U捕獲一顆中子,變為239U,再經β–衰變形成239Np和239Pu。
(箭頭下的時間為半衰期)
進一步捕獲中子並進行β–衰變後,樣本會變為241Am,再轉換為242Cm:
實際研究在製造鋦的時候,並不對鈾進行照射,而是用鈈。乏核燃料中含有大量的鈈,能夠輕易地提取使用。如果使用高中子通量的輻射,能通過另一條反應鏈形成244Cm:[9]
鋦-244在釋放α粒子後,會衰變成240Pu;同時它會吸收中子,產生少量更重的鋦同位素。這些同位素包括247Cm和248Cm,由於半衰期很長,因此常被用於科學研究。不過,由於247Cm在熱中子撞擊下容易裂變,因此該同位素在熱中子反應爐中的產率較低。[74]經中子捕獲產生250Cm的可能性同樣很低,因為中間產物249Cm的半衰期非常短(64分鐘),並會經β–衰變成為錇的249Bk同位素。[74]
(A = 244–248)
以上一連串的(n,γ)反應會產生不同鋦同位素的混合物。合成後的分離過程十分繁複,所以科學家一般選擇性地合成特定鋦同位素。由於半衰期很長,鋦-248最常用於研究用途。該同位素最有效率的合成方法是通過鉲-252的α衰變。因為252Cf具有長半衰期(2.65年),因此容易大量取得。每年通過這種方法產生的248Cm大約有35至50 mg,同位素純度為97%。[74]
另一種研究常用的同位素245Cm可經由249Cf的α衰變產生,而249Cf可由249Bk的β–衰變產生。
鋦金屬的製備编辑

一般的合成產物含有不同鋦同位素的氧化物混合物。要分離出其中一種同位素,可以將乏核燃料(如混合氧化物核燃料)溶於硝酸中,再使用磷酸三丁酯和烴類的混合物,通過鈾鈈分離(PUREX)來萃取出大部分的鈾和鈈。然後利用二酰胺來萃取水溶殘餘物(殘液)中剩餘的鑭系元素和錒系元素。產物將會是三價錒系及鑭系元素的混合物。要分離出當中的鋦化合物,可用多重步驟的層析法及離心法,並使用適當的試劑。[29]:34-48其中一種可用來專門提取鋦的試劑為雙三嗪基二吡啶配合物。[75]如要使鋦從非常相似的鋂中分離出來,可將兩者氫氧化物的混合漿狀物置於碳酸氫鈉水溶液中,並在加熱後加入臭氧。大部分的鋂和鋦在溶液中都具有+3價態。其中鋂會被氧化,形成可溶的Am(IV)配合物,而鋦則不會改變,故可再重復用離心法提取出來。[29]:25
科學家通過對鋦化合物進行還原反應來取得處於金屬態的鋦元素。其中一種可用於製備鋦金屬的化合物為三氟化鋦。反應必須在不含水或氧的環境下進行,使用鉭和鎢造的器具,並以鋇或鋰作為還原劑。[9][18][76][77][78]
應用编辑
放射性同位素编辑

鋦是其中一種放射性最強的可分離元素。其兩種最常見的同位素242Cm和244Cm都是強α粒子射源(能量為6 MeV),其半衰期相對較短,分別為162.8天和18.1年,每克所釋放的功率分別為120瓦和3瓦。[15][80][81]因此氧化鋦可被用於太空船中的放射性同位素熱電機。科學家曾研究過如何用244Cm同位素發電,而242Cm則因價格昂貴(每克約2000美元)而不能使用。鋦-243的半衰期約為30年,每克功率達到1.6瓦,故可用作燃料,但它的核衰變產物會釋放大量有害的γ和β射線。244Cm所釋放的α粒子無須大量輻射防護,但其自發裂變率很高,因此具有高中子輻射和γ輻射。相比同樣用於放射性同位素熱電機的238Pu,244Cm釋放的中子通量高出500倍;它釋放強烈的γ射線,所需的輻射防護也高出20倍。功率為1 kW的樣本需要約5 cm的鉛作防護,而238Pu只需0.1 cm的鉛。這樣的應用在目前來說是不切實際的。[73]
其中一項鋦的實際應用是利用242Cm同位素來產生心律調節器中用於發電的238Pu。如不使用這種方法,則要通過237Np的(n,γ)反應,或用氘撞擊鈾,才能形成238Pu。這些過程都會產生236Pu,而這種副產品會衰變為釋放大量γ輻射的208Tl,不適合加入心律調節器中。[82]
科學家常使用鋦來產生更重的超鈾元素和錒系後元素。用氧(18O )或鎂(26Mg )撞擊248Cm,可以產生𨭎(265Sg)和𨭆(269Hs和270Hs)。[33]:1980-1981勞倫斯伯克利國家實驗室用能量為35 MeV的α粒子撞擊重數微克的鋦-242,發現了鉲元素:
- 242
96Cm
+ 4
2He
→ 245
98Cf
+ 1
0
n

X射線光譜儀编辑
同位素244Cm最實際的用途是在α粒子X射線光譜儀(APXS)中作α粒子射源,但可用體積有限。火星探路者、火星車、火星96、勇氣號、火星探測漫游者、機遇號和火星科學實驗室都使用了這種儀器來分析火星表面岩石的成份和結構。[83]測量員5至7號月球探測器也使用了APXS,但所用的α粒子源是242Cm。[69][84][85]
APXS上裝有一個傳感器頭,裏面含有6個鋦α粒子源,其總放射性衰變率為幾十毫居里(約十億貝可勒爾)。射源對準樣本後,儀器就會分析從樣本散射出來的α粒子和質子的能譜(只有某些光譜儀有分析質子的功能)。這些能譜包含有關所有主要元素量的信息(氫、氦和鋰除外)。[86]羅塞塔號的菲萊登陸器(Philae Lander)也將用APXS來探測楚留莫夫-格拉希門克彗星的表面。[87]
安全编辑
由於具有放射性,鋦必須在適當的實驗室中用特殊的器材處理。鋦元素本身主要釋放α粒子,用很薄的普通材質就可以吸收阻擋。然而鋦的一些衰變產物卻會釋放大量β及γ輻射,因此需要更加嚴密的保護措施。[37]一旦攝入體內,鋦會在幾天以內被排除體外,只剩餘0.05%會吸收到血液內。血液中45%的鋦會進入肝臟,45%進入骨骼,餘下10%經排泄離開身體。骨骼中的鋦會積累在與骨組織與骨髓的接觸面上,而且不會隨時間明顯地分散。其輻射會破壞骨髓和其製造紅血球的能力。鋦的生物半衰期在肝臟中約為20年,而在骨骼中則為50年。[37][69]鋦更容易通過呼吸進入體內,其中244Cm在水溶態時的最高允許可攝入量為0.3 μC。[15]含242Cm和244Cm的溶液在經靜脈注射進入老鼠的體內後,会导致其患上骨腫瘤的可能增大;經吸入後,則有可能造成肺癌和肝癌。[37]
乏核燃料中不可避免地會含有鋦同位素,大約每噸含20克鋦。[88]其中245Cm至248Cm同位素的半衰期有數千年之久,必須先從要棄置的乏核燃料中分離出來。[89]鋦分離出來後,要在反應爐中經中子撞擊,成為短半衰期的核素。這種方法稱為核轉化,科學家目前正在研發鋦的核轉化過程。[27]
參考資料编辑
- ^ Kovács, Attila; Dau, Phuong D.; Marçalo, Joaquim; Gibson, John K. Pentavalent Curium, Berkelium, and Californium in Nitrate Complexes: Extending Actinide Chemistry and Oxidation States. Inorg. Chem. (American Chemical Society). 2018, 57 (15): 9453–9467. OSTI 1631597. PMID 30040397. S2CID 51717837. doi:10.1021/acs.inorgchem.8b01450.
- ^ Domanov, V. P.; Lobanov, Yu. V. Formation of volatile curium(VI) trioxide CmO3. Radiochemistry (SP MAIK Nauka/Interperiodica). October 2011, 53 (5): 453–6. S2CID 98052484. doi:10.1134/S1066362211050018.
- ^ Domanov, V. P. Possibility of generation of octavalent curium in the gas phase in the form of volatile tetraoxide CmO4. Radiochemistry (SP MAIK Nauka/Interperiodica). January 2013, 55 (1): 46–51. doi:10.1134/S1066362213010098.
- ^ Zaitsevskii, Andréi; Schwarz, W H Eugen. Structures and stability of AnO4 isomers, An = Pu, Am, and Cm: a relativistic density functional study. Physical Chemistry Chemical Physics. April 2014, 2014 (16): 8997–9001. Bibcode:2014PCCP...16.8997Z. PMID 24695756. doi:10.1039/c4cp00235k.
- ^ 锔的+8氧化态据报告可能存在于四氧化锔(CmO4)中[3],但更新的实验似乎表明不存在+8氧化态的锔。[4]
- ^ 6.0 6.1 6.2 Schenkel, R. The electrical resistivity of 244Cm metal. Solid State Communications. 1977, 23 (6): 389. Bibcode:1977SSCom..23..389S. doi:10.1016/0038-1098(77)90239-3.
- ^ Hall, Nina. The New Chemistry: A Showcase for Modern Chemistry and Its Applications. Cambridge University Press. 2000: 8–9 [2013-03-22]. ISBN 978-0-521-45224-3. (原始内容存档于2014-01-01).
- ^ Seaborg, G. T.; James, R. A. and Ghiorso, A.: "The New Element Curium (Atomic Number 96)", NNES PPR (National Nuclear Energy Series, Plutonium Project Record), Vol. 14 B, The Transuranium Elements: Research Papers, Paper No. 22.2, McGraw-Hill Book Co., Inc., New York, 1949; Abstract (页面存档备份,存于互联网档案馆); Full text (January 1948) (页面存档备份,存于互联网档案馆).
- ^ 9.0 9.1 9.2 9.3 9.4 Morss, L. R.; Edelstein, N. M. and Fugere, J. (eds): The Chemistry of the Actinide Elements and transactinides, volume 3, Springer-Verlag, Dordrecht 2006, ISBN 978-1-4020-3555-5.
- ^ 10.0 10.1 Pepling, Rachel Sheremeta. Chemical & Engineering News: It's Elemental: The Periodic Table – Americium. 2003 [07-12-2008]. (原始内容存档于2007-12-27).
- ^ Krebs, Robert E. The history and use of our earth's chemical elements: a reference guide (页面存档备份,存于互联网档案馆), Greenwood Publishing Group, 2006, ISBN 978-0-313-33438-2 p. 322
- ^ Harper, Douglas. pandemonium. Online Etymology Dictionary.
- ^ 13.0 13.1 13.2 Audi, G. The N? evaluation of nuclear and decay properties (PDF). Nuclear Physics A. 1997, 624 (1): 1. Bibcode:1997NuPhA.624....1A. doi:10.1016/S0375-9474(97)00482-X. (原始内容 (PDF)存档于2008-09-23).
- ^ Greenwood, p. 1252
- ^ 15.0 15.1 15.2 15.3 15.4 Hammond C. R. "The elements" in Lide, D. R. (编), CRC Handbook of Chemistry and Physics 86th, Boca Raton (FL): CRC Press, 2005, ISBN 0-8493-0486-5
- ^ L. B. Werner, I. Perlman: "Isolation of Curium", NNES PPR (National Nuclear Energy Series, Plutonium Project Record), Vol. 14 B, The Transuranium Elements: Research Papers, Paper No. 22.5, McGraw-Hill Book Co., Inc., New York, 1949.
- ^ National Academy of Sciences. Isadore Perlman 1915–1991. Nap.edu. [2011-03-25]. (原始内容存档于2013-06-01).
- ^ 18.0 18.1 Wallmann, J. C.; Crane, W. W. T.; Cunningham, B. B. The Preparation and Some Properties of Curium Metal. Journal of the American Chemical Society. 1951, 73 (1): 493–494. doi:10.1021/ja01145a537.
- ^ Werner, L. B.; Perlman, I. First Isolation of Curium. Journal of the American Chemical Society. 1951, 73 (1): 5215–5217. doi:10.1021/ja01155a063.
- ^ 20.0 20.1 Milman, V. Crystal structures of curium compounds: an ab initio study. Journal of Nuclear Materials. 2003, 322 (2–3): 165. Bibcode:2003JNuM..322..165M. doi:10.1016/S0022-3115(03)00321-0.
- ^ Young, D. A. Phase diagrams of the elements (页面存档备份,存于互联网档案馆), University of California Press, 1991, ISBN 978-0-520-07483-5p. 227
- ^ Haire, R; Peterson, J; Benedict, U; Dufour, C; Itie, J. X-ray diffraction of curium-248 metal under pressures of up to 52 GPa. Journal of the Less Common Metals. 1985, 109 (1): 71. doi:10.1016/0022-5088(85)90108-0.
- ^ Kanellakopulos, B. The magnetic susceptibility of Americium and curium metal. Solid State Communications. 1975, 17 (6): 713. Bibcode:1975SSCom..17..713K. doi:10.1016/0038-1098(75)90392-0.
- ^ Fournier, J. Curium: A new magnetic element. Physica B+C. 1977, 86–88: 30. Bibcode:1977PhyBC..86...30F. doi:10.1016/0378-4363(77)90214-5.
- ^ Nave, S. E.; Huray, P. G.; Peterson, J. R. and Damien, D. A. Magnetic susceptibility of curium pnictides (页面存档备份,存于互联网档案馆), Oak Ridge National Laboratory
- ^ Schenkel, R. The electrical resistivity of 244Cm metal. Solid State Communications. 1977, 23 (6): 389. Bibcode:1977SSCom..23..389S. doi:10.1016/0038-1098(77)90239-3.
- ^ 27.0 27.1 27.2 Denecke, Melissa A.; Rossberg, André; Panak, Petra J.; Weigl, Michael; Schimmelpfennig, Bernd; Geist, Andreas. Characterization and Comparison of Cm(III) and Eu(III) Complexed with 2,6-Di(5,6-dipropyl-1,2,4-triazin-3-yl)pyridine Using EXAFS, TRFLS, and Quantum-Chemical Methods. Inorganic Chemistry. 2005, 44 (23): 8418. PMID 16270980. doi:10.1021/ic0511726.
- ^ 28.0 28.1 Bünzli, J.-C. G. and Choppin, G. R. Lanthanide probes in life, chemical, and earth sciences: theory and practice, Elsevier, Amsterdam, 1989 ISBN 978-0-444-88199-1
- ^ 29.0 29.1 29.2 29.3 Penneman, R. A.; Keenan, T. K. The radiochemistry of americium and curium. Los Alamos, California: Univsity of California. 1960 [2020-09-20]. (原始内容存档于2013-05-15).
- ^ Keenan, Thomas K. First Observation of Aqueous Tetravalent Curium. Journal of the American Chemical Society. 1961, 83 (17): 3719. doi:10.1021/ja01478a039.
- ^ 31.0 31.1 31.2 Asprey, L. B.; Ellinger, F. H.; Fried, S.; Zachariasen, W. H. Evidence for Quadrivalent Curium: X-Ray Data on Curium Oxides1. Journal of the American Chemical Society. 1955, 77 (6): 1707. doi:10.1021/ja01611a108.
- ^ Greenwood, p. 1265
- ^ 33.0 33.1 33.2 Holleman, Arnold F.; Wiberg, Nils. Textbook of Inorganic Chemistry. Berlin: 102 Edition, de Gruyter. 2007: 1956. ISBN 978-3-11-017770-1.
- ^ Jensen, Mark P.; Bond, Andrew H. Comparison of Covalency in the Complexes of Trivalent Actinide and Lanthanide Cations. Journal of the American Chemical Society. 2002, 124 (33): 9870. PMID 12175247. doi:10.1021/ja0178620.
- ^ Seaborg, G. T. Overview of the Actinide and Lanthanide (the f) Elements. Radiochimica Acta. 1993, 61: 115–122.
- ^ Greenwood, p. 1267
- ^ 37.0 37.1 37.2 37.3 37.4 Curium (页面存档备份,存于互联网档案馆)(德文)
- ^ Greenwood, p. 1268
- ^ Noe, M. Self-radiation effects on the lattice parameter of 244CmO2. Inorganic and Nuclear Chemistry Letters. 1971, 7 (5): 421. doi:10.1016/0020-1650(71)80177-0.
- ^ Haug, H. Curium sesquioxide Cm2O3. Journal of Inorganic and Nuclear Chemistry. 1967, 29 (11): 2753. doi:10.1016/0022-1902(67)80014-9.
- ^ Fuger, J; Haire, R; Peterson, J. Molar enthalpies of formation of BaCmO3 and BaCfO3. Journal of Alloys and Compounds. 1993, 200 (1–2): 181. doi:10.1016/0925-8388(93)90491-5.
- ^ Keenan, T. Lattice constants of K7Cm6F31 trends in the 1:1 and 7:6 alkali metal-actinide(IV) series. Inorganic and Nuclear Chemistry Letters. 1967, 3 (10): 391. doi:10.1016/0020-1650(67)80092-8.
- ^ Asprey, L. B.; Keenan, T. K.; Kruse, F. H. Crystal Structures of the Trifluorides, Trichlorides, Tribromides, and Triiodides of Americium and Curium. Inorganic Chemistry. 1965, 4 (7): 985 [2022-01-23]. doi:10.1021/ic50029a013. (原始内容存档于2022-04-24).
- ^ Burns, J. Crystallographic studies of some transuranic trihalides: 239PuCl3, 244CmBr3, 249BkBr3 and 249CfBr3. Journal of Inorganic and Nuclear Chemistry. 1975, 37 (3): 743. doi:10.1016/0022-1902(75)80532-X.
- ^ Wallmann, J. Crystal structure and lattice parameters of curium trichloride. Journal of Inorganic and Nuclear Chemistry. 1967, 29 (11): 2745. doi:10.1016/0022-1902(67)80013-7.
- ^ Weigel, F; Wishnevsky, V; Hauske, H. The vapor phase hydrolysis of PuCl3 and CmCl3: heats of formation of PuOC1 and CmOCl. Journal of the Less Common Metals. 1977, 56 (1): 113. doi:10.1016/0022-5088(77)90224-7.
- ^ Troc, R. Actinide Monochalcogenides, Volume 27 (页面存档备份,存于互联网档案馆), Springer, 2009 ISBN 978-3-540-29177-0, p. 4
- ^ Damien, D. Preparation and lattice parameters of curium sulfides and selenides. Inorganic and Nuclear Chemistry Letters. 1975, 11 (7–8): 451. doi:10.1016/0020-1650(75)80017-1.
- ^ Elschenbroich, Ch. Organometallic Chemistry, 6th edition, Wiesbaden 2008, ISBN 978-3-8351-0167-8, p. 589
- ^ Kerridge, Andrew; Kaltsoyannis, Nikolas. Are the Ground States of the Later Actinocenes Multiconfigurational? All-Electron Spin−Orbit Coupled CASPT2 Calculations on An(η8-C8H8)2(An = Th, U, Pu, Cm). The Journal of Physical Chemistry A. 2009, 113 (30): 8737. PMID 19719318. doi:10.1021/jp903912q.
- ^ Girnt, Denise; Roesky, Peter W.; Geist, Andreas; Ruff, Christian M.; Panak, Petra J.; Denecke, Melissa A. 6-(3,5-Dimethyl-1H-pyrazol-1-yl)-2,2′-bipyridine as Ligand for Actinide(III)/Lanthanide(III) Separation. Inorganic Chemistry. 2010, 49 (20): 9627. PMID 20849125. doi:10.1021/ic101309j.
- ^ 52.0 52.1 Glorius, M.; Moll, H.; Bernhard, G. Complexation of curium(III) with hydroxamic acids investigated by time-resolved laser-induced fluorescence spectroscopy. Polyhedron. 2008, 27 (9–10): 2113. doi:10.1016/j.poly.2008.04.002.
- ^ 53.0 53.1 Heller, Anne; Barkleit, Astrid; Bernhard, Gert; Ackermann, Jörg-Uwe. Complexation study of europium(III) and curium(III) with urea in aqueous solution investigated by time-resolved laser-induced fluorescence spectroscopy. Inorganica Chimica Acta. 2009, 362 (4): 1215. doi:10.1016/j.ica.2008.06.016.
- ^ 54.0 54.1 Moll, Henry; Johnsson, Anna; Schäfer, Mathias; Pedersen, Karsten; Budzikiewicz, Herbert; Bernhard, Gert. Curium(III) complexation with pyoverdins secreted by a groundwater strain of Pseudomonas fluorescens. BioMetals. 2007, 21 (2): 219. PMID 17653625. doi:10.1007/s10534-007-9111-x.
- ^ 55.0 55.1 Moll, Henry; Geipel, Gerhard; Bernhard, Gert. Complexation of curium(III) by adenosine 5′-triphosphate (ATP): A time-resolved laser-induced fluorescence spectroscopy (TRLFS) study. Inorganica Chimica Acta. 2005, 358 (7): 2275. doi:10.1016/j.ica.2004.12.055.
- ^ Biochemical Periodic Table – Curium. Umbbd.msi.umn.edu. 2007-06-08 [2011-03-25]. (原始内容存档于2011-07-19).
- ^ Moll, H; Stumpf, T; Merroun, M; Rossberg, A; Selenska-Pobell, S; Bernhard, G. Time-resolved laser fluorescence spectroscopy study on the interaction of curium(III) with Desulfovibrio äspöensis DSM 10631T. Environmental Science & Technology. 2004, 38 (5): 1455–9. PMID 15046347. doi:10.1021/es0301166.
- ^ Ozaki, T.; et al. Association of Eu(III) and Cm(III) with Bacillus subtilis and Halobacterium salinarium. Journal of Nuclear Science and Technology. 2002,. Suppl. 3: 950–953 [2013-03-22]. (原始内容存档于2009-02-25).
- ^ Pfennig, G.; Klewe-Nebenius, H. and Seelmann Eggebert, W. (Eds.): Karlsruhe nuclide, 6th Ed. 1998
- ^ Kang, Jungmin; Von Hippel, Frank. Limited Proliferation-Resistance Benefits from Recycling Unseparated Transuranics and Lanthanides from Light-Water Reactor Spent Fuel (PDF). Science and Global Security. 2005, 13 (3): 169 [2013-03-22]. doi:10.1080/08929880500357682. (原始内容存档 (PDF)于2013-03-26).
- ^ Osaka, M.; et al. Analysis of Curium Isotopes in Mixed Oxide Fuel Irradiated in Fast Reactor (PDF). Journal of Nuclear Science and Technology. 2001, 38 (10): 912–914 [2013-05-23]. doi:10.3327/jnst.38.912. (原始内容存档于2019-07-10).
- ^ Sasahara, Akihiro; Matsumura, Tetsuo; Nicolaou, Giorgos; Papaioannou, Dimitri. Neutron and Gamma Ray Source Evaluation of LWR High Burn-up UO2 and MOX Spent Fuels. Journal of Nuclear Science and Technology. 2004, 41 (4): 448–456 [2013-05-23]. doi:10.3327/jnst.41.448. (原始内容存档于2019-07-10).
- ^ 63.0 63.1 Institut de Radioprotection et de Sûreté Nucléaire: "Evaluation of nuclear criticality safety. data and limits for actinides in transport" (页面存档备份,存于互联网档案馆), p. 16
- ^ National Research Council (U.S.). Committee on Separations Technology and Transmutation Systems. Nuclear wastes: technologies for separations and transmutation. National Academies Press. 1996: 231– [19 April 2011]. ISBN 978-0-309-05226-9. (原始内容存档于2016-04-27).
- ^ Okundo, H. and Kawasaki, H. Critical and Subcritical Mass Calculations of Curium-243 to -247 Based on JENDL-3.2 for Revision of ANSI/ANS-8.15. Journal of Nuclear Science and Technology. 2002, 39 (10): 1072–1085 [2013-05-23]. doi:10.3327/jnst.39.1072. (原始内容存档于2019-07-10).
- ^ § 2 Begriffsbestimmungen (Atomic Energy Act) (页面存档备份,存于互联网档案馆)(德文)
- ^ Jukka Lehto; Xiaolin Hou. Chemistry and Analysis of Radionuclides: Laboratory Techniques and Methodology. Wiley-VCH. 2 February 2011: 303– [19 April 2011]. ISBN 978-3-527-32658-7. (原始内容存档于2016-06-10).
- ^ Fields, P.; Studier, M.; Diamond, H.; Mech, J.; Inghram, M.; Pyle, G.; Stevens, C.; Fried, S.; Manning, W. Transplutonium Elements in Thermonuclear Test Debris. Physical Review. 1956, 102 (1): 180. Bibcode:1956PhRv..102..180F. doi:10.1103/PhysRev.102.180.
- ^ 69.0 69.1 69.2 Human Health Fact Sheet on Curium 互联网档案馆的存檔,存档日期2006-02-18., Los Alamos National Laboratory
- ^ Earth, Rachel Ross 2017-05-23T02:31:00Z Planet. Facts About Americium. livescience.com. 23 May 2017 [2019-08-10]. (原始内容存档于2022-04-24) (英语).
- ^ Americium - Element information, properties and uses | Periodic Table. www.rsc.org. [2019-08-10]. (原始内容存档于2022-05-21).
- ^ Emsley, John. Nature's Building Blocks: An A-Z Guide to the Elements New. New York, NY: Oxford University Press. 2011. ISBN 978-0-19-960563-7.
- ^ 73.0 73.1 Basic elements of static RTGs (页面存档备份,存于互联网档案馆), G.L. Kulcinski, NEEP 602 Course Notes (Spring 2000), Nuclear Power in Space, University of Wisconsin Fusion Technology Institute (see last page)
- ^ 74.0 74.1 74.2 Haire, Richard G. Curium. Morss; Edelstein, Norman M.; Fuger, Jean (编). The Chemistry of the Actinide and Transactinide Elements (PDF) 3rd. Dordrecht, The Netherlands: Springer Science+Business Media. 2006: 1401 [2013-03-22]. ISBN 1-4020-3555-1. (原始内容存档 (PDF)于2010-07-17).
- ^ Magnusson D, Christiansen B, Foreman MRS, Geist A, Glatz JP, Malmbeck R, Modolo G, Serrano-Purroy D and Sorel C. Demonstration of a SANEX Process in Centrifugal Contactors using the CyMe4-BTBP Molecule on a Genuine Fuel Solution. Solvent Extraction and Ion Exchange. 2009, 27 (2): 97. doi:10.1080/07366290802672204.
- ^ Cunningham, B.B.; Wallmann, J.C. Crystal structure and melting point of curium metal. Journal of Inorganic and Nuclear Chemistry. 1964, 26 (2): 271. doi:10.1016/0022-1902(64)80069-5.
- ^ Stevenson, J; Peterson, J. Preparation and structural studies of elemental curium-248 and the nitrides of curium-248 and berkelium-249. Journal of the Less Common Metals. 1979, 66 (2): 201. doi:10.1016/0022-5088(79)90229-7.
- ^ Gmelin Handbook of Inorganic Chemistry, System No. 71, Volume 7 a, transuranics, Part B 1, pp. 67–68.
- ^ Eubanks, I. Preparation of curium metal. Inorganic and Nuclear Chemistry Letters. 1969, 5 (3): 187. doi:10.1016/0020-1650(69)80221-7.
- ^ Binder, Harry H.: Lexikon der chemischen Elemente, S. Hirzel Verlag, Stuttgart 1999, ISBN 978-3-7776-0736-8, pp. 174–178.
- ^ Gmelin Handbook of Inorganic Chemistry, System No. 71, Volume 7a, transuranics, Part A2, p. 289
- ^ Kronenberg, Andreas (页面存档备份,存于互联网档案馆), Plutonium-Batterien 互联网档案馆的存檔,存档日期2013-12-26.(德文)
- ^ Rieder, R.; Wanke, H.; Economou, T. An Alpha Proton X-Ray Spectrometer for Mars-96 and Mars Pathfinder. Bulletin of the American Astronomical Society. 09/1996, 28: 1062. Bibcode:1996DPS....28.0221R.
- ^ Leitenberger, Bernd Die Surveyor Raumsonden (页面存档备份,存于互联网档案馆)(德文)
- ^ Nicks, Oran. Ch. 9. Essentials for Surveyor. SP-480 Far Travelers: The Exploring Machines. NASA. 1985 [2013-03-22]. (原始内容存档于2012-10-19).
- ^ Alpha Particle X-Ray Spectrometer (APXS) (页面存档备份,存于互联网档案馆), Cornell University
- ^ Der Rosetta Lander Philae. Bernd-leitenberger.de. 2003-07-01 [2011-03-25]. (原始内容存档于2011-06-11).
- ^ Hoffmann, K. Kann man Gold machen? Gauner, Gaukler und Gelehrte. Aus der Geschichte der chemischen Elemente, Urania-Verlag, Leipzig, Jena, Berlin 1979, no ISBN, p. 233(德文)
- ^ Baetslé, L. H. Application of Partitioning/Transmutation of Radioactive Materials in Radioactive Waste Management 互联网档案馆的存檔,存档日期2005-04-26., Nuclear Research Centre of Belgium Sck/Cen, Mol, Belgium, September 2001.
書目编辑
- Greenwood, Norman Neill; Earnshaw, Alan. Chemistry of the elements. 2016. ISBN 978-0-7506-3365-9. OCLC 1040112384 (英语).
- Holleman, Arnold F.; Wiberg, Nils. Textbook of Inorganic Chemistry. Berlin: 102 Edition, de Gruyter. 2007. ISBN 978-3-11-017770-1.
- Penneman, R. A.; Keenan, T. K. The radiochemistry of americium and curium. Los Alamos, California: Univsity of California. 1960 [2020-09-20]. (原始内容存档于2013-05-15).
外部連結编辑
| 维基共享资源中相关的多媒体资源:锔 |
| 查看维基词典中的词条「curium」。 |
- 元素锔在洛斯阿拉莫斯国家实验室的介紹(英文)
- EnvironmentalChemistry.com —— 锔(英文)
- 元素锔在The Periodic Table of Videos(諾丁漢大學)的介紹(英文)
- 元素锔在Peter van der Krogt elements site的介紹(英文)
- WebElements.com – 锔(英文)
- NLM Hazardous Substances Databank – Curium, Radioactive (页面存档备份,存于互联网档案馆)